Apa yang dimaksud pH? bagaimana cara perhitungan pH asam basa?
pH didefinisikan sebagai negatif logaritma konsentrasi molar ion H+ dan
pOH sebagai negatif logaritma konsentrasi molar ion OH–. Dalam bentuk matematis
ditulis sebagai:
Berdasarkan definisi tersebut, pH dan pOH untuk air pada 25°C dapat
dihitung sebagai berikut.
pH = –log [H+] = –log (1,0 × 10–7) = 7
pOH = –log [OH–] = –log (1,0 × 10–7) = 7
Prosedur yang sama juga diterapkan untuk menghitung tetapan
ionisasi air, yaitu pKw.
Kw = [H+] [OH– ] = 1,0 × 10–14
pKw = pH + pOH = 14
pH = 14 – pOH dan pOH = 14 – pH
Perhitungan pH Asam dan Basa Kuat Monoprotik
Jika sobat melarutkan HCl 0,1 mol ke dalam air sampai volume
larutan 1 liter, dihasilkan larutan HCl 0,1M. Berapakah pH larutan tersebut?
Derajat keasaman atau pH larutan ditentukan oleh konsentrasi ion H+ sesuai
rumus pH = –log [H+]. Untuk mengetahui konsentrasi H+ dalam larutan perlu
diketahui seberapa besar derajat ionisasi asam tersebut. HCl tergolong asam
kuat dan terionisasi sempurna membentuk ionionnya:
HCl(aq) → H+(aq) + Cl–(aq)
Sehingga dalam larutan HCl 0,1 M terdapat [H+] = [Cl–] = 0,1 M.
Disamping itu, air juga memberikan sumbangan ion H+ dan OH– sebagai
hasil ionisasi air, masing-masing sebesar 1,0 × 107 M.
Jika konsentrasi H+ hasil ionisasi air dibandingkan dengan
konsentrasi H+ hasil ionisasi HCl, sumbangan H+ dari air sangat kecil
sehingga dapat diabaikan. Apalagi jika ditinjau dari prinsip Le Chatelier,
penambahan ion H+ (HCl) ke dalam air akan menggeser posisi kesetimbangan
air ke arah pembentukan molekul air.
H2O(l) ← H+(aq) + OH–(aq).
Dengan demikian, pH larutan HCl 0,1M hanya ditentukan oleh
konsentrasi ion H+ dari HCl. pH (HCl 0,1M) = –log [H+] = –log (1 × 10–1) =
1.
Basa kuat seperti NaOH dan KOH, jika dilarutkan dalam air akan
terionisasi sempurna dan bersifat elektrolit kuat. Persamaan ionnya:
NaOH(aq) → Na+(aq) + OH–(aq)
Berapakah pH larutan basa kuat NaOH 0,01 M? Untuk mengetahui hal
ini, perlu ditinjau spesi apa saja yang terdapat dalam larutan NaOH 0,01M. Oleh
karena NaOH adalah basa kuat maka dalam larutan NaOH 0,01 M akan terdapat [Na+]
= [OH–] = 0,01 M. Disamping itu, ionisasi air juga memberikan sumbangan [H+] =
[OH ] = 1,0 × 10–7 M.
Penambahan ion OH– (NaOH) ke dalam air akan menggeser posisi
kesetimbangan ionisasi air sehingga sumbangan OH– dan H+ dari air
menjadi lebih kecil dan dapat diabaikan. Dengan demikian, perhitungan pH
larutan hanya ditentukan oleh konsentrasi ion OH– dari NaOH melalui
hubungan:
pKw = pH + pOH.
pH = pKw – pOH = 14 – (– log (1 × 10–2) )= 12
Perhitungan pH Asam dan Basa Lemah Monoprotik
Seperti telah diuraikan sebelumnya, konsentrasi ion-ion dalam
larutan asam lemah ditentukan oleh nilai tetapan ionisasi asam (Ka).
Untuk asam monoprotik, pH larutan asam lemah dapat ditentukan dari
persamaan berikut.
Demikian juga untuk basa lemah, konsentrasi ion OH– dalam
larutan basa lemah ditentukan oleh tetapan ionisasi basa (Kb).
Untuk basa monovalen, pH larutan basa lemah dapat dihitung dari
persamaan berikut.
Perhitungan pH Asam dan Basa Poliprotik
Apakah yang dimaksud dengan asam poliprotik? Asam-asam seperti H2SO4,
H2CO3, H2C2O4, dan H3PO4 tergolong asam poliprotik. Berdasarkan contoh
tersebut, sobat dapat menyimpulkan bahwa asam poliprotik adalah asam yang dapat
melepaskan lebih dari satu proton (ion H+).
Di dalam air, asam-asam tersebut melepaskan proton secara bertahap
dan pada setiap tahap hanya satu proton yang dilepaskan. Jumlah proton yang
dilepaskan bergantung pada kekuatan asamnya.
Untuk asam-asam kuat seperti H2SO4, pelepasan proton yang pertama
sangat besar, sedangkan pelepasan proton kedua relatif kecil dan
berkesetimbangan. Asam-asam lemah seperti H2CO3, pelepasan proton pertama dan
kedua relatif kecil dan berkesetimbagan.
Tinjaulah asam lemah diprotik, misalnya H2CO3. Di dalam air, H2CO3 terionisasi
membentuk kesetimbangan. Persamaannya:
Oleh karena ada dua tahap ionisasi maka ada dua harga tetapan
kesetimbangan, ditandai dengan Ka1 dan Ka2, dimana Ka1 >> Ka2.

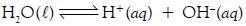





Tidak ada komentar:
Posting Komentar